近期beat365亚洲版官网材料制剂与再生医学中心肖健研究员课题组在脊髓损伤方向取得进展。
脊髓损伤(SCI)是一种高度致残的灾难性疾病,常导致永久性瘫痪和各种运动、感觉和自主神经系统功能障碍,严重影响生活质量和预期寿命,目前依然缺乏有效的治疗方法。已有研究利用成纤维细胞生长因子(FGF)治疗SCI,但FGF不能在脊髓损伤部位积聚,并且不能有效穿透血脊髓屏障(BSCB),导致其应用仍是一个挑战。课题组将具有损伤靶向能力的CAQK肽(Cp)和具有BSCB穿透能力的R2KC肽(Rp)接枝到脂质体上,构建了一种双靶向脂质体(bFGF@Lip-Cp&Rp),能够缓释递送bFGF治疗SCI,且具有损伤部位靶向和穿透BSCB功能。研究表明双靶向脂质体可穿过BSCB并在损伤部位积聚,在SCI的早期阶段,bFGF@Lip-Cp&Rp促进BSCB的修复并促进巨噬细胞的M2极化,并促进血管新生,改善病变部位的微环境,抑制神经元凋亡、促进轴突再生。相关工作在《Materials Today Bio》(中科院一区,IF 10.76)上报道。
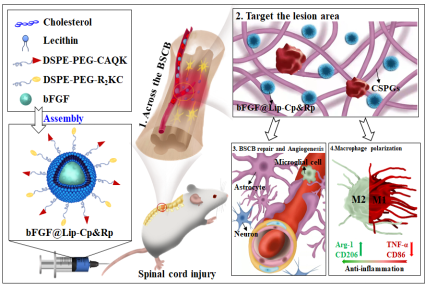
论文链接:https://linkinghub.elsevier.com/retrieve/pii/S2590-0064(23)00006-6
课题组发现一种生长因子衍生物环螺旋B肽(CHBP)能够治疗SCI。坏死和焦亡作为两种促炎程序性细胞死亡方式在SCI中发挥重要作用,课题组发现CHBP显著改善SCI后的大鼠运动功能。分子机制研究显示CHBP通过AMPK-FOXO3a-SPK2-CARM1和AMPK-mTOR信号通路,诱导转录因子TFEB的去磷酸化和核转位,进而介导自噬水平上调来抑制神经元焦亡和坏死,而自噬抑制剂能够减弱CHBP的神经保护作用。因此CHBP可作为治疗SCI的潜在药物。相关工作在《Redox Biol》(中科院一区,IF 10.787)上报道。
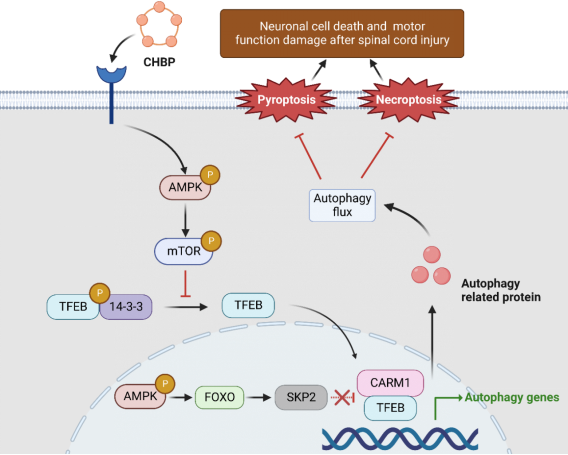
论文链接: https://linkinghub.elsevier.com/retrieve/pii/S2213231723001684
血脊髓屏障(BSCB)损伤是SCI后的重要病理因素。越来越多的证据表明,急性创伤性SCI诱导的自噬和自噬-溶酶体通路(ALP)缺陷可能导致损伤后内皮屏障的破坏。课题组发现SCI诱导溶酶体损伤,破坏自噬通量,促进内皮细胞ALP功能障碍。一种调控自噬的关键分子开关KLF2的表达水平在SCI后降低,过表达KLF2可改善BSCB功能,促进SCI小鼠运动功能的恢复。KLF2通过增强SCI后ALP功能,抑制TJ蛋白降解和细胞凋亡,维持内皮屏障完整性。因此KLF2可能是修复BSCB完整性的一个有前景的治疗靶点,可用于治疗和改善SCI预后。相关工作在《Theranostics》(中科院一区,IF 11.6)上报道。

论文链接:https://www.thno.org/v13p0849.htm.
课题组在临床实践中发现SCI患者合并有糖尿病时,糖尿病将促进BSCB破坏并加重脊髓损伤,然而其分子机制尚不清楚。课题组发现,一种重要的体内氧化应激感受器--离子通道TRPM2在其中发挥重要作用。糖尿病可显著加重SCI大鼠BSCB中内皮细胞(ECs)的线粒体功能障碍,促进ECs凋亡。糖尿病还可以通过下调HIF-1α,VEGF和ANG1等蛋白的表达水平,从而抑制SCI大鼠脊髓损伤处新生血管的形成。高血糖可诱导内皮细胞产生过量的ROS,TRPM2作为ROS的细胞传感器被激活。TRPM2通过介导Ca2+内流,激活p-CaMKII/eNOS通路从而诱导ROS上调,最终导致SCI后ECs大量凋亡及血管生成受阻。使用TRPM2抑制剂或siRNA抑制TRPM2均能减轻ECs凋亡,促进血管生成,从而促进BSCB完整性的恢复。因此TRPM2可能是促进糖尿病合并SCI修复的重要靶点。相关工作在《Int J Biol Sci》(中科院一区,IF 10.75)上报道。
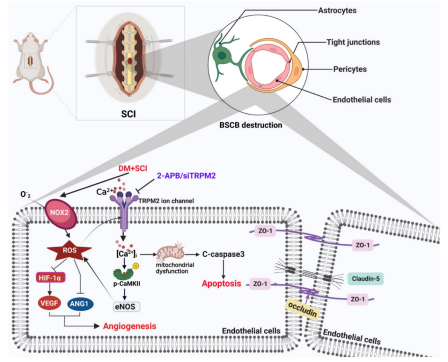
论文链接: https://www.ijbs.com/v19p2475.htm